Применение плазмы, богатой факторами роста (PRGF), в лечении андрогенетической алопеции
Аннотация
Предпосылки: Андрогенетическая алопеция (AGA) – это распространенное заболевание волосяного покрова, которым страдают мужчины и женщины по всему миру. Хотя это состояние отнюдь не представляет угрозы для жизни, психосоциальные последствия AGA могут вызвать стресс и существенное ухудшение качества жизни. Целью данного ретроспективного исследования является изучение безопасности и эффективности аутологичной плазмы, богатой факторами роста ENDORET (PRGF), в лечении AGA.
Методы: В это исследование были включены сто пациентов. Они проходили два интрадермальных цикла введения ENDORET PRGF каждые 4 недели. С целью оценить общее улучшение и определить соотношение волос, находящихся в фазах анагена/телогена, были соответственно выполнены макрофотографии и трихограммы волос перед началом лечения и спустя 4 месяца после первого курса лечения.
Результаты: Пациенты показали общее увеличение густоты волос. Анализ трихограмм волос показал, что доля волос в фазе анагена существенно увеличилась на 6,2 процентных пункта (p<0,05) по сравнению с исходными уровнями, в то время как для волос в фазе телогена наблюдалось снижение на 5,1 пункта (p<0,05). О нежелательных явлениях не сообщалось ни в одном случае.
Выводы: Хотя требуется провести дополнительные рандомизированные клинические исследования, наши данные позволяют предположить, что ENDORET PRGF оказывает положительный терапевтический эффект на андрогенетическую алопецию и не демонстрирует никаких побочных действий, связанных с протоколом лечения.
Уровень доказательности: уровень III, терапевтическое исследование.
Введение
Андрогенетическая алопеция (AGA), также известная как облысение, является наиболее распространенной формой облысения. К возрасту 50–60 лет AGA развивается у 45% мужчин, в то время как 35% женщин также страдает этим нарушением [1, 2]. Характерные клинические проявления AGA связаны с изменением количества и распределения андрогенных рецепторов и ферментов, влияющих на превращение стероидных гормонов, в наружном корневом влагалище волосяных фолликулов, включая 5α-редуктазу и цитохром P-450-ароматазы [3]. Впрочем, механизм, лежащий в основе андрогенетической алопеции, одинаков для мужчин и для женщин. Патогенез включает в себя прогрессирующую нерубцовую миниатюризацию волосяных фолликулов, что клинически выражается в том, что фолликулы терминальных волос трансформируются во фолликулы пушковых волос. Помимо этого, развивается прогрессирующее снижение продолжительности фазы анагена наряду с уменьшением соотношения волосяных фолликулов, находящихся в фазе анагена и в фазе телогена [4]. Хотя облысение по мужскому типу представляет собой безвредное медицинское состояние, страдающие им лица испытывают огромный психоэмоциональный стресс, часто приводящий к снижению качества жизни и вторичной смертности [5]. В настоящее время существует не так много надежных способов лечения AGA, при этом Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (Food and Drug Administration) одобрило только миноксидил для местного применения и финастерид для перорального применения [6]. Однако в этом случае наблюдаются некоторые побочные эффекты, например, с применением миноксидила связывают зуд кожи головы, сухость, шелушение и жжение, в то время как прием финастерида может сопровождаться снижением либидо и эректильной дисфункцией [7, 8]. В последнее время также проводится оценка инновационных подходов, связанных с применением стволовых клеток [9] и рекомбинантных факторов роста [10]. Еще один интересный способ лечения основывается на применении аутологичной плазмы и тромбоцитарных белков. Действительно, существуют исследования, демонстрирующие обнадеживающие результаты применения аутологичной технологии при андрогенетической алопеции [11, 12].
Плазма, богатая факторами роста ENDORET (PRGF), представляет собой на 100% аутологичную терапию, основанную на введении пула биологически активных молекул, которые в конечном итоге повышают собственные регенеративные возможности организма. Благодаря более чем 20 годам исследований и уникальным свойствам технология плазмотерапии ENDORET PRGF не имеет аналогов. Эта технология предполагает отбор небольшого количества собственной крови пациента, которую затем разделяют на центрифуге и активируют, чтобы получить аутологичный препарат, обогащенный белками и факторами роста. В отличие от других доступных в продаже продуктов из богатой тромбоцитами плазмы, ENDORET PRGF не содержит провоспалительных лейкоцитов [13–15], и помимо этого, недавно было продемонстрировано, что плазмотерапия ENDORET PRGF обладает значительным противомикробным эффектом [16]. Благодаря своей высокой универсальности препарат ENDORET PRGF нашел применение во многих других областях медицины, включая дерматологию [17, 18], эстетическую медицину [19], ортопедическую хирургию [20], спортивную медицину [21, 22], офтальмологию [23–25], нейробиологию [26] и челюстно-лицевую хирургию [27]. Биологически активные регуляторы, присутствующие в ENDORET PRGF, стимулируют тканевую регенерацию и активируют множество биологических процессов, включая рекрутинг, пролиферацию, миграцию клеток, клеточную дифференцировку, образование новых сосудов и накопление внеклеточного матрикса [28, 29].
Доказано, что плазма, богатая факторами роста, является мощным индуктором восстановления биологических функций и регенерации кожи, поэтому целью данного исследования является оценить, способны ли факторы роста реактивировать цикл волосяных фолликулов, стимулируя соединительнотканный сосочек и клетки зародышевой матрицы. Была проведена оценка нескольких пациентов с AGA, чтобы выявить безопасность и потенциальную возможность применения этой инновационной технологии при облысении. Основные результаты были получены путем анализа стандартизированных трихограмм для оценки процентных долей волос в фазе анагена и в фазе телогена до и после интрадермального лечения ENDORET PRGF. Кроме того, в оба момента времени выполнялись фотографии, чтобы оценить улучшение роста волос.
Материал и методы
Пациенты
Дизайн ретроспективного исследования соответствовал всем принципам Хельсинкской декларации. Это исследование включало в себя 100 пациентов с андрогенетической алопецией легкой и средней тяжести, проходивших плазмотерапию ENDORET PRGF с января 2012 года по декабрь 2013 года. Для всех пациентов производилась оценка до начала лечения и спустя 3 месяца после лечения ENDORET PRGF. С целью оценить общее улучшение и определить соотношение волос, находящихся в фазах анагена/ телогена, были соответственно выполнены макрофотографии и трихограммы.
Приготовление плазмы, богатой факторами роста (Endoret-PRGF)
Сначала у каждого пациента производили забор 18 мл периферической крови, которую помещали в пробирки объемом 9 мл, содержащие 3,8% (массо-объемные проценты) цитрата натрия. Затем кровь центрифугировали (система BTI System IV, Витория (Vitoria), Испания) при 580 g в течение 8 минут. Верхний видимый слой плазмы разделяли на фракцию 1 (F1) и фракцию 2 (F2). F2 определяется как столб в 2 см3 богатой тромбоцитами плазмы прямо над лейкоцитарной пленкой, а F1 — как оставшийся объем плазмы над F2. Бедную тромбоцитами фракцию F1 отбраковывали, и в исследовании использовалась исключительно богатая тромбоцитами фракция F2. Лейкоцитарную пленку не включали во фракцию F2, чтобы предотвратить провоспалительное действие цитокинов, которые высвобождаются макрофагами и лимфоцитами. Наконец, в собранную фракцию F2 добавляли активатор PRGF (BTI Biotechnology Institute, SL, Миньяно, Испания), чтобы спровоцировать высвобождение факторов роста альфа-гранулами тромбоцитов. В заключение, активированную PRGF немедленно вводили в кожу головы пациента (рис. 1).
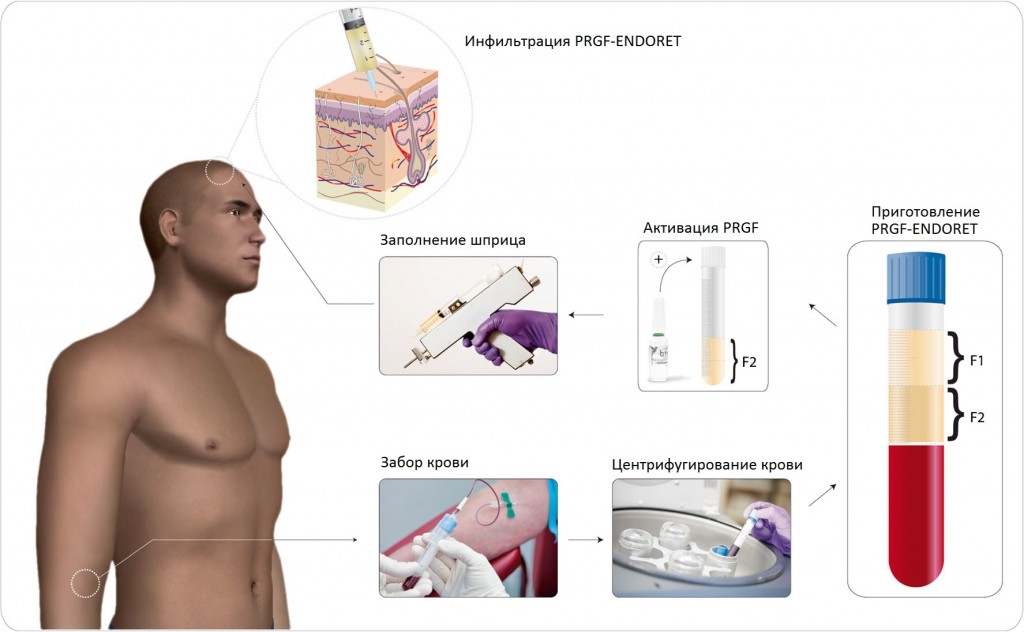
Рис. 1. Схема последовательности приготовления PRGF-Endoret. У пациента брали периферическую венозную кровь и центрифугировали ее в системе с одинарным центрифугированием. Фракцию F1, бедную тромбоцитами плазму, отбраковывали, а фракцию F2, плазму, богатую факторами роста, активировали и вводили интрадермально в кожу головы пациента с помощью пистолета для мезотерапии.
Протокол лечения
Перед началом лечения все пациенты дали информированное согласие в письменном виде. Для каждого пациента был выполнен общий анализ крови, чтобы подтвердить пригодность пациента для лечения плазмотерапией ENDORET PRGF. Кроме того, все пациенты прошли клиническое обследование, чтобы исключить любые симптомы воспаления, рубцевания или эритемы.
2,5–3 мл активированного препарата PRGF-Endoret набирали в шприц 10 мл и сразу вводили интрадермально с помощью игл 30G. Для этих инъекций использовался электронный пистолет DHN1 для мезотерапии (Dismedical, Мадрид, Испания). После каждого сеанса лечения выполнялся легкий массаж головы, чтобы снять боль вокруг участка, куда выполнялась инъекция, а также распределить PRGF по всей коже головы. Пациенты проходили два сеанса лечения с перерывом в 1 месяц между ними.
Клиническая оценка
Положительное действие плазмотерапии ENDORET PRGF при лечении андрогенетической алопеции оценивалось по общим фотографиям, выполненным с помощью цифрового фотоаппарата (NikonD700, Токио, Япония). Кроме того, выполнялись стандартизированные трихограммы волос, чтобы определить фазу цикла роста волоса после лечения. Все пациенты проходили оценку перед первым сеансом лечения и спустя 3 месяца после последнего сеанса. Трихограммы волос выполнялись экспертом слепым методом. С помощью зажима Кохера с теменной зоны кожи головы пациента аккуратно брали двадцать отдельных волос. Щипцы зажима помещали на расстоянии примерно в 1 мм от кожи головы и с усилием тянули волос в направлении роста волос. После взятия волос их помещали на предметное стекло и фиксировали при помощи покровного стекла. Наконец, подсчитывали количество волос в фазе анагена (активный рост) и телогена (фаза покоя), используя оптический микроскоп и объективы ×2,5 и ×5. Были получены характерные изображения волос в фазах анагена и телогена (Leica DM IRB, Leica Microsystems, Вецлар (Wetzlar), Германия) (Рис. 2).

Рис. 2. Макрофотографии, сделанные после анализа трихограмм с объективами a ×2,5 и b ×5. На рисунках показан фолликул волоса в фазе телогена (слева) и фолликул волоса в фазе анагена (справа)
Статистический анализ
Был проведен полный анализ методом описательной статистики. Для всех качественных показателей были вычислены распределения абсолютной и относительной частоты, в то время как для количественных показателей оценивались средние значения и средние квадратичные отклонения. После проверки гипотезы о нормальном распределении показателей (критерий Шапиро-Уилка), которое не наблюдалось ни в одном случае, разницу в процентных долях анагеновых и телогеновых волос между состояниями до и после лечения PRGF анализировали с помощью непараметрического критерия Уилкоксона. Кроме того, исследовалось возможное влияние пола на итоговые результаты методом линейного регрессионного анализа. Во всех случаях уровень статистической значимости составлял 5% (p<0,05). Для статистического анализа использовался программный пакет статистической обработки SPSS v15.0 для Windows (SPSS Inc., Чикаго, Иллинойс (IL), США).
Результаты
В исследование были включены и оценены сто пациентов с AGA. Пятьдесят из них были мужчинами (50%), а оставшиеся 50 были женщинами (50%). Для объективного анализа клинического улучшения сравнивали трихограммы волос в точке времени 0 и 3 месяца после последнего сеанса лечения PRGF (рис. 3). До лечения доля волосяных фолликулов в фазе анагена достигала 56,12% (среднее квадратичное отклонение = 5,0; медиана 54,0; 95% доверительный интервал 54,4–57,1) от общего количества волос, в то время как волосяные фолликулы в фазе телогена составляли 25,86% (среднее квадратичное отклонение = 5,0; медиана 27,0; 95% доверительный интервал 24,8–27,1). Что интересно, после лечения доля волосяных фолликулов в фазе анагена возросла до 62,97% (среднее квадратичное отклонение = 3; медиана 63,0; 95% доверительный интервал 60,7–62,8), в то время как процентная доля волос в фазе телогена уменьшилась до 20,12% (среднее квадратичное отклонение = 2,0; медиана 20,0; 95% доверительный интервал 20,4–21,8) (p < 0,05). Эти результаты показывают, что лечение PRGF существенно увеличило количество волос в фазе анагена и одновременно значительно уменьшило количество волос в фазе телогена.
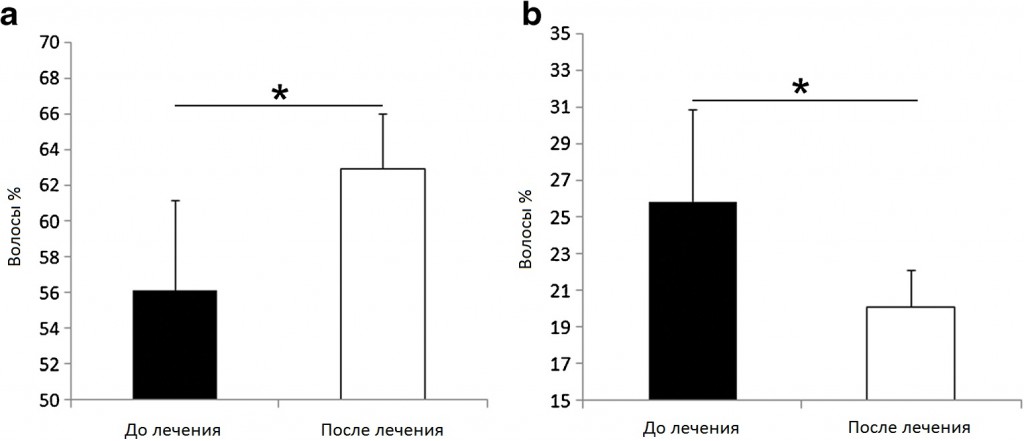
Рис. 3. a Процентная доля фолликулов в фазе анагена существенно возросла после лечения PRGF, при этом b наблюдалось снижение доли фолликулов в фазе телогена. *p<0,05
Возможное влияние пола на результаты лечения ENDORET PRGF оценивалось методом линейного регрессионного анализа. Не было выявлено никакой связи ни в повышении количества волос анагеновой фазы (p=0,67), ни в уменьшении телогеновой фазы (p=0,73).
В любом случае, результаты были представлены раздельно для мужчин и женщин, и было замечено, что, несмотря на то, что положительное действие ENDORET PRGF было аналогичным для обоих полов, среди женщин улучшение было несколько большим. У женщин доля фолликулов в фазе анагена возросла на 6,4 процентных пункта, а доля фолликулов в фазе телогена уменьшилась на 5,3 пункта. У мужчин доля фолликулов в фазе анагена возросла на 6 процентных пунктов, а доля фолликулов в фазе телогена уменьшилась на 4,9 пункта.
Все пациенты по завершении периода наблюдения были удовлетворены результатами. Сравнение фотографий до и после лечения показало клиническое улучшение на отметке 3 месяца после процедуры (рис. 4).
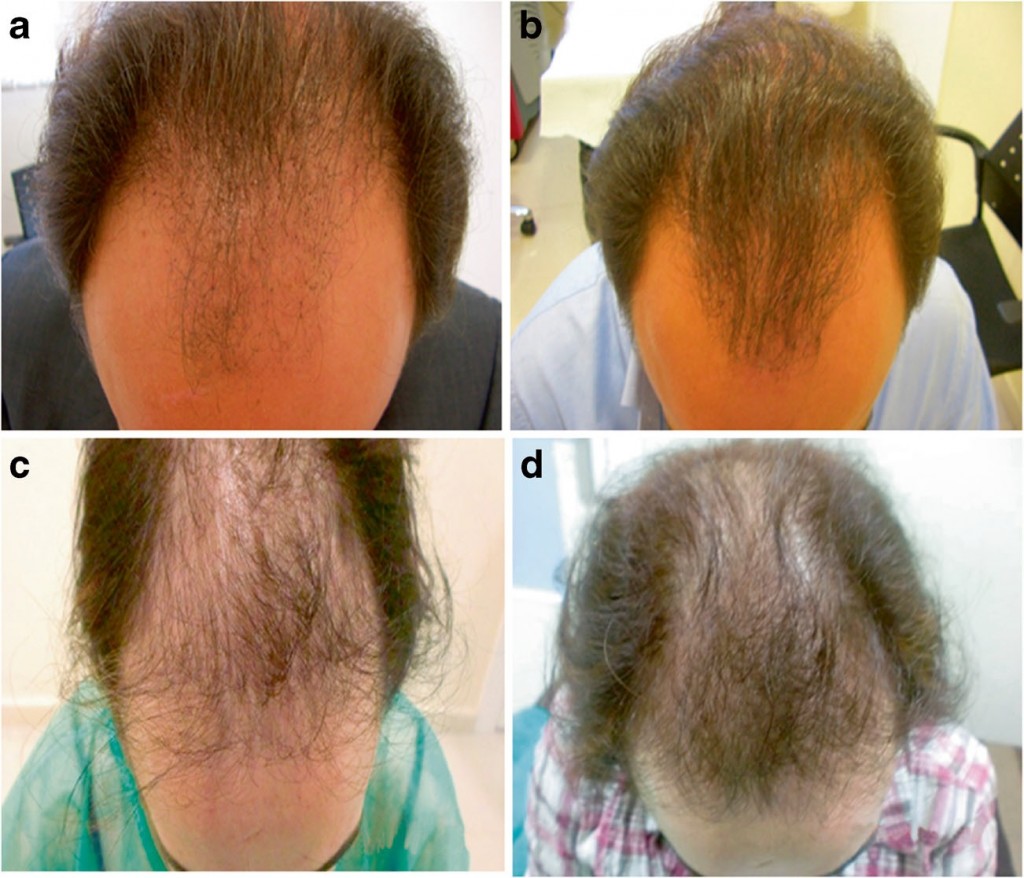
Рис. 4. Характерные фотографии двух пациентов с андрогенетической алопецией. a, b Мужчина среднего возраста до и после лечения PRGF-Endoret, соответственно. c, d Женщина средне-старшего возраста до и после лечения PRGF-Endoret, соответственно.
Субъективно густота волос существенно повысилась на тех участках, где потеря волос вследствие андрогенетической алопеции была особенно тяжелой.
В это исследование было включено всего 100 пациентов, страдающих андрогенетической алопецией. Никакие отрицательные действия не наблюдались, за исключением временной эритемы и местного отека, которые прошли через 24 часа после лечения плазмой, богатой факторами роста.
Обсуждение
В тромбоцитах периферической крови присутствует большое количество альфа-гранул, содержащих многочисленные факторы роста и цитокины. ENDORET PRGF содержит тромбоциты в оптимальной концентрации, и после активации они высвобождают смесь аутологичных факторов роста и некоторых биоактивных молекул из фракции плазмы. Кроме того, в результате превращения фибриногена в плазме в фибрин на месте инфильтрации образуется сгусток, который действует как превосходный каркас, который в течение нескольких дней непрерывно высвобождает все большее количество белков [30]. Вот некоторые из этих белков: тромбоцитарный фактор роста (PDGF), фактор роста фибробластов (FGF), трансформирующий фактор роста β1 (TGFβ1), сосудистый эндотелиальный фактор роста (VEGF), фактор роста гепатоцитов (HGF), инсулиноподобный фактор роста (IGF) и эпидермальный фактор роста (EGF) [31, 32]. После высвобождения ускоряются различные этапы тканевой регенерации, например гемостаз, воспаление, образование грануляционной ткани, эпителизация, образование новых сосудов и накопление внеклеточного матрикса, а также значительно сокращается время до полного выздоровления [33, 34].
Аналогичным образом, восстановление биологических функций кожи и регенерация фолликулов включают в себя координирование нескольких молекулярных сигналов, регулирующих переход между фазами цикла роста волос. Некоторые такие сигналы опосредуются факторами роста, присутствующими в ENDORET PRGF, например IGF-1 и FGF [35]. Кроме того, доказано, что VEGF-опосредованный ангиогенез является мощным индуктором отрастания волос вследствие перифолликулярной васкуляризации [36]. Помимо этого, было показано, что упомянутый выше PDGF и его рецептор играют ключевую роль во взаимодействии клеток соединительнотканного сосочка и фолликулярных кератиноцитов, необходимом для образования волосяного канала и роста мезенхимы кожи [37, 38]. Также был продемонстрирован пролиферативный эффект фактора роста кератиноцитов 2 (KGF-2) и его рецептора, рецептора фактора роста фибробластов 2 (FGFR2), на клетки волосяного фолликула [10].
Уменьшение соотношения количества волос в фазах анагена и телогена является визитной карточкой AGA [39], поэтому наша гипотеза заключалась в том, что в основе терапии PRGF лежит механизм, позволяющий вмешиваться в ход цикла роста волос, чтобы поддерживать высокой долю волос в фазе анагена и уменьшать количество волос в фазе телогена. Обычный цикл развития волосяного фолликула включает в себя фазу роста (анаген), переходную фазу (катаген) и фазу покоя (телоген), и наиболее надежным и неинвазивным способом определения фазы цикла роста волоса является упомянутая выше трихограмма волос [40, 41]. В нашем исследовании использовались трихограммы, сделанные до лечения и спустя 4 месяца после лечения. Волосы в фазе анагена отличались темной пигментацией луковицы и наличием волосяной сумки, а также однородными стержнями. Однако у волос в фазе телогена пигментация была недостаточной, волосяная сумка отсутствовала, а их корень утолщался, приобретая характерную булавовидную форму. Результаты после лечения ENDORET PRGF показали рост количества волос в фазе анагена на 7 процентных пунктов с одновременным уменьшением количества волос в фазе телогена на 6 пунктов. Эти результаты согласуются с некоторыми предварительными оценками, показавшими эффективность собственных белков пациентов при лечении андрогенетической алопеции [42–44]. Однако во всех пробных исследованиях соблюдались разные протоколы лечения, отличавшиеся по способу приготовления плазмы и вводимым дозам, и, что еще важнее, количество проанализированных случаев невелико. В данное исследование мы включили 100 случаев пациентов с AGA, проходивших два сеанса лечения ENDORET PRGF. Результаты анализа трихограмм подтвердили общее улучшение, выражавшееся в удовлетворенности пациентов и увеличении густоты волос, которое наблюдалось на фотографиях, сделанных после лечения.
Необходимо провести дополнительные исследования, чтобы объяснить молекулярные механизмы лечения андрогенетической алопеции с помощью ENDORET PRGF. Однако уже есть исследования, пролившие свет на действие этой инновационной терапии на развитие волосяных фолликулов. Предполагается, что одним из ключевых факторов является антиапоптотическое действие аутологичных белков, поскольку активация антиапоптотических регуляторов Bcl-2 и Akt продлевает срок жизни клеток соединительнотканного сосочка в течение цикла роста волоса. Кроме того, повышающая регуляция сигнальных путей FGF-7/b-катенина после лечения аутологичными факторами роста вызывает дифференцировку стволовых клеток волосяных фолликулов и продлевает фазу анагена [45]. Кроме того, было показано, что после данного лечения наблюдается увеличение пролиферации клеток соединительнотканного сосочка за счет повышающей регуляции митогенетического сигнального пути ERK. Также в клеточной культуре аутологичной плазмы наблюдалась связанная с клеточным циклом сверхэкспрессия циклина D1 и Cdk4 [46].
Требуются дальнейшие лабораторные исследования, чтобы в полной мере понять биологические механизмы, лежащие в основе лечения андрогенетической алопеции с помощью ENDORET PRGF. Кроме того, вариабельность и малое количество клинических испытаний позволяют продолжить оптимизировать протокол лечения. Однако наши предварительные результаты позволяют предположить, что терапия плазмой, богатой факторами роста, может представлять собой безопасное и эффективное лечение облысения, поскольку на 4 месяце периода последующего наблюдения существенно возросло соотношение количества волос в фазах анагена/телогена.
Конфликт интересов Эдуардо Анитуа (Eduardo Anitua) и Андер Пино (Ander Pino) являются научными сотрудниками BTI Biotechnology Institute. Данная биотехнологическая компания разработала технологию плазмы, богатой факторами роста. Наварро М. Р. (Navarro MR), Асин М. (Asín M), Мартинес А. М. (Martínez AM), Молина С. (Molina C), Наварро В. (Navarro V) и Ориве Г. (Orive G) заявляют, что у них нет конфликта интересов.
Одобрение комиссии по этике Все процедуры, выполнявшиеся в ходе данного исследования с привлечением людей-участников, проводились в соответствии с этическими стандартами организации и/или государственной комиссии по научным исследованиям, а также с требованиями Хельсинкской декларации 1964 года с ее последующими изменениями либо в соответствии со сравнимыми этическими стандартами.
Данное исследование является ретроспективным, таким образом, для данного типа исследования формальное согласие не требуется.
Согласие пациентов Пациенты дали письменное согласие на использование их изображений.
Литература
1. Hamilton JB (1951) Patterned loss of hair in man: types and inci- dence. Ann N Y Acad Sci 53:708–728
2. Norwood OT (2001) Incidence of female androgenetic alopecia (female pattern alopecia). Dermatol Surg 27:53–54
3. Sawaya ME, Price VH (1997) Different levels of 5α-reductase type I and II, aromatase and androgen receptor in hair follicles of women and men with androgenetic alopecia. J Invest Dermatol 109:296–300
4. Blume-Peytavi U, Blumeyer A, Tosti A, Finner A, Marmol V, Trakatelli M, Reygagne P, Messenger A (2011) S1 guideline for diagnostic alopecia in men, women and adolescents. Br J Dermatol 164:5–15
5. de Koning EB, Passchier J, Dekker FW (1990) Psychological prob- lems with hair loss in general practice and the treatment policies of general practitioners. Psychol Rep 67:775–778
6. Duarte V, de Sousa IC, Tosti A (2013) New investigational drugs for androgenetic alopecia. Expert Opin Investig Drugs 22:573–589
7. Georgala S, Befon A, Maniatopoulou E, Georgala C (2007) Topical use of minoxidil in children and systemic side effects. Dermatology 214:101–102
8. Irwig MS, Kolukula S (2011) Persistent sexual side effects of finas- teride for male pattern hair loss. J Sex Med 8:1747–1753
9. Toyoshima KE, Asakawa K, Ishibashi N, Toki H, Ogawa M, Hasegawa T, Irié T, Tachikawa T, Sato A, Takeda A, Tsuji T (2012) Fully functional hair follicle regeneration through the rear- rangement of stem cells and their niches. Nat Commun 3:784
10. Jang JH (2005) Stimulation of human hair growth by the recombi- nant human keratinocyte growth factor-2 (KGF-2). Biotechnol Lett 27:749–752
11. Kang JS, Zheng Z, Choi MJ, Lee SH, Kim DY, Cho SB (2014) The effect of CD34+ cell containing autologous platelet rich plasma injection on pattern hair loss: a preliminary study. J Eur Acad Dermatol Venereol 28:72–79
12. Takikawa M, Nakamura S, Nakamura S, Ishirara M, Kishimoto S, Sasaki K, Yanagibayashi S, Azuma R, Yamamoto N, Kiyosawa T (2011) Enhanced effect of platelet rich plasma containing a new carrier on hair growth. Dermatol Surg 37:1721–1729
13. Anitua E, Sánchez M, Prado R, Orive G (2014) The type of platelet- rich plasma may influence the safety of the approach. Knee Surg Sports Traumatol Arthrosc 22:1708–1709
14. Anitua E, Sánchez M (2012) We cannot take oranges for apples in the field of platelet-rich plasma products. Scand J Med Sci Sports 22:147–148
15. Anitua E, Zalduendo MM, Alkhraisat MH, Orive G (2013) Release kinetics of platelet-derived and plasma-derived growth factors from autologous plasma rich in growth factors. Ann Anat 195:461–466
16. Anitua E, Alonso R, Girbau C, Aguirre JJ, Muruzabal F, Orive G (2012) Antibacterial effect of plasma rich in growth factors (PRGF- Endoret) against Staphylococcus Aureus and Staphylococcus Epidermidis strains. Clin Exp Dermatol 37:652–657
17. Anitua E, Aguirre JJ, Algorta J, Ayerdi E, Cabezas AI, Orive G, Andia I (2008) Effectiveness of autologous preparation rich in growth factors for the treatment of chronic cutaneous ulcers. J Biomed Mater Res B Appl Biomater 84:415–421
18. Orcajo B, Muruzabal F, Isasmendi MC, Gutierrez N, Sánchez M, Orive G, Anitua E (2011) The use of plasma rich in growth factors (PRGF-Endoret) in the treatment of a severe mal perforant ulcer in the foot of a person with diabetes. Diabetes Res Clin Pract 93:65–67
19. Anitua E, Sanchez M, Sarabia R, Sanz J, Aguirre JJ, Orive G (2011) Eficacia y seguridad del PRGF(plasma rico en factores de crecimiento) en la regeneración cutanea facial. Ensayo clínico, randomizado y controlado con ácido hialurónico. AECEP 23–33.
20. Sánchez M, Fiz N, Azofra J, Usabiaga J, Aduriz Recalde E, Garcia Gutierrez A, Albillos J, Gárate R, Aguirre JJ, Padilla S, Orive G, Anitua E (2012) A randomized clinical trial evaluating plasma rich in growth factors (PRGF-Endoret) versus hyaluronic acid in the short term treatments of symptomatic knee osteoarthritis. Arthroscopy 28:1070–1078
21. Anitua E, Sanchez M, Nurden AT, Zalduendo M, de la Fuente M, Orive G, Azofra J, Andia I (2006) Autologous fibrin matrices: a potential source of biological mediators that modulate tendon cell activities. J Biomed Mater Res A 77:285–293
22. Sánchez M, Anitua E, Azofra J, Andía I, Padilla S, Mujika I (2007) Comparison of surgically repaired Achilles tendon tears using plate- let rich fibrin matrices. Am J Sports Med 35:245–251
23. Panda A, Jain M, Vanathi M, Velpandian T, Khokhar S, Dada T
(2012) Topical autologous platelet rich plasma eyedrops for acute corneal chemical injury. Cornea 31:989–993
24. Anitua E, Sanchez M, Merayo-Lloves J, De la Fuente M, Muruzabal F, Orive G (2011) Plasma rich in growth factors (PRGF-Endoret) stimulates proliferation and migration of primary keratocytes and conjunctival fibroblasts and inhibits and reverts
TGFβ1 induced myodifferentiation. Invest Ophthalmol Vis Sci 52:6066–6073
25. Anitua E, Muruzabal F, Pino A, Merayo-Lloves J, Orive G (2013) Biological stability of plasma rich in growth factors eye drops after storage of 3 months. Cornea
26. Anitua E, Pascual C, Pérez-Gonzalez R, Antequera D, Padilla S, Orive G, Carro E (2013) Intranasal delivery of plasma and platelet growth factors using PRGF-Endoret system enhances neurogenesis in a mouse model of Alzheimer’s disease. PLoS One 8:73118
27. Anitua E, Begoña L, Orive G (2012) Treatment of hemimandibular paresthesia in a patient with bisphosphonate-related osteonecrosis of the jaw (BRONJ) by combining surgical resection and PRGF- Endoret. Br J Oral Maxillofac Surg 51:272–274
28. Barrientos S, Stojadinovic O, Golinko MS, Brem H, Tomic-Canic M (2008) Growth factors and cytokines in wound healing. Wound Repair Regen 16:585–601
29. Yang HS, Shin J, Bhang SH, Shin JY, Park J, Im GI, Kim CS, Kim BS (2011) Enhanced skin wound healing by a sustained release of growth factors contained in platelet rich plasma. Exp Mol Med 43:622–629
30. Anitua E, Zalduendo MM, Prado R, Alkhraisat MH, Orive G (2014) Morphogen and proinflamatory cytokine release kinetics from PRGF-Endoret fibrin scaffolds: evaluation of the effect of leukocyte inclusion. J Biomed Mater Res A
31. Chen FM, Zhang M, Wu ZF (2010) Toward delivery of multiple growth factors in tissue engineering. Biomaterials 31:6279–308
32. Rendu F, Brohard-Bohn B (2001) The platelet release reac- tion: granules’ constituents, secretion and functions. Platelets 12:261–73
33. Gurtner GC, Werner S, Barrandon Y, Longaker MT (2008) Wound repair and regeneration. Nature 453:314–321
34. Madeddu P (2005) Therapeutic angiogenesis and vasculogenesis for tissue regeneration. Exp Physiol 90:315–326
35. Paus R, Cotsarelis G (1999) The biology of hair follicles. N Engl J Med 341:491–497
36. Yano K, Brown LF, Detmar M (2001) Control of hair growth and follicle size by VEGF mediated angiogenesis. J Clin Invest 107: 409–417
37. Kamp H, Geilen CC, Sommer C, Blume-Peytavi U (2003) Regulation of PDGF and PDGF receptor in cultured dermal papilla cells and follicular keratinocytes of the human hair follicle. Exp Dermatol 12:662–672
38. Takakura N, Yoshida H, Kunisada T, Nishikawa S, Nishikawa SI (1996) Involvement of platelet derived growth factor receptor α in hair canal formation. J Invest Dermatol 107:770–777
39. Tosti A, Gray J (2007) Assessment of hair scalp disorders. J Investig Dermatol Symp Proc 12:23–27
40. Schneider MR, Schmidt-Ullrich R, Paus R (2009) The hair follicle as a dynamic miniorgan. Curr Biol 19:132–142
41. Serrano-Falcón C, Fernández-Pugnaire MA, Serrano-Ortega S (2013) Hair scalp evaluation: the trichogram. Actas Dermosifiliogr 104:867–876
42. Sclafani AP (2014) Platelet rich fibrin matrix (PRFM) for androge- netic alopecia. Facial Plast Surg 30:219–224
43. Trink A, Sorbellini E, Bezzola P, Rodella L, Rezzani R, Ramot Y, Rinaldi F (2013) Platelet rich plasma injection is effective and safe for the treatment of alopecia. Br J Dermatol 169:690–694
44. Schiavone G, Raskovic D, Greco J, Abeni D (2014) Platelet rich plas- ma for androgenetic alopecia: a pilot study. Dermatol Surg 40:1010–9
45. Li ZJ, Choi HI, Choi DK, Sohn KC, Im M, Seo YJ, Lee YH, Lee JH, Lee Y (2012) Autologous platelet rich plasma: a potential tool for promoting hair growth. Dermatol Surg 38:1040–1046
46. Rastegar H, Ahmadi Ashtiani H, Aghaei M, Ehsani A, Barikbin B (2013) Combination of herbal extracts and platelet rich plasma in- duced dermal papilla cell proliferation: involvement of ERK and Akt pathways. J Cosmet Dermatol 12:116–122






